
产品货号:
YT046
中文名称:
His标签蛋白纯化试剂盒(还原剂和螯合剂耐受)
英文名称:
GoldBalb His-tag Protein Purification Kit
产品规格:
10T
发货周期:
1~3天
产品价格:
询价
本制品是一种采用了新型的GoldBalb His-tag Purification Resin的可以兼容还原剂和螯合剂,并能简单、快速、高效并且高特异性地纯化His标签蛋白的试剂盒。试剂盒提供了His标签蛋白所需的相关试剂和亲和层析柱空柱管,为His标签蛋白的纯化带来了极大的便利。

蛋白样品溶液通过GoldBalb His-tag Purification Resin时,重组蛋白His标签上的组氨酸残基能特异性地结合到GoldBalb His-tag Purification Resin中的镍离子上,其它蛋白则不能被结合。洗涤后,His标签重组蛋白可在非变性条件下被洗脱,从而被分离纯化。

| 组分 | 规格 |
| GoldBalb His-tag Purification Resin | 10mL |
| 非变性裂解液 | 120mL |
| 非变性洗涤液 | 60mL |
| 非变性洗脱液 | 60mL |
| 溶菌酶 | 60mg |
| 亲和层析柱空柱管(3mL) | 10套 |
保存:4℃,有效期一年。除GoldBalb His-tag Purification Resin外,其余均可以-20℃保存。

一个包装的本制品足够进行10次His标签重组蛋白纯化,每次细菌沉淀的湿重约为1克。每次蛋白的最大纯化量为10~15mg,具体的最大纯化量和蛋白分子量有关;对于分子量为50kD的带有His标签重组蛋白,每次的蛋白最大纯化量为3~10mg。在不使用亲和层析柱空柱管的情况下,参考本说明书本试剂盒足够进行500次的小量His标签蛋白纯化。

- 请勿在-20℃或更低温度冷冻保存GoldBalb His-tag Purification Resin。
- GoldBalb His-tag Purification Resin储存在30%乙醇中,10mL总体积中5mL为凝胶,5mL为液体,需要充分重悬后再吸取。
- GoldBalb His-tag Purification Resin使用过程中,缓冲试剂如Tris、HEPES、MOPS等的浓度不宜超过100mM,EDTA浓度不宜超过20mM,SDS和sarkosyl的浓度不宜超过0.3%,Triton、Tween、NP-40的浓度不宜超过2%,脱氧胆酸钠、CHAPS的浓度不宜超过1%,组氨酸浓度不宜超过20mM,钙离子浓度不宜超过5mM,钠离子和镁离子浓度可以高达2M,甘油浓度可以高达50%。其它未提及试剂的兼容性可以参考上述试剂,但还有待实验验证。
- GoldBalb His-tag Purification Resin保存和纯化过程中应始终保持凝胶湿润。
- 若离心不能完全除去蛋白样品中的不溶物,可以将样品溶液用0.45μm的滤膜过滤。
- 蛋白样品收集后宜尽快完成纯化工作,并应始终放置在4℃或冰浴,以减缓蛋白降解。为有效抑制蛋白降解,可以在裂解液中添加适量的蛋白酶抑制剂混合物。
- 若使用本说明书提供的条件无法达到理想的纯化效果,可尝试改变洗涤液和洗脱液中咪唑的浓度和(或)pH,以达到最优效果。

对于用镍柱纯化大肠杆菌中His标签蛋白比较熟悉的使用者可以直接参考“四、简化的操作流程”。否则请参考如下详细内容:如下以最常见的大肠杆菌中表达纯化His标签重组蛋白为例,说明本制品的使用方法。在其它体系中表达时,请参考该表达体系的相关使用说明,并借鉴大肠杆菌中纯化His标签重组蛋白的使用说明。
一、大肠杆菌中可溶性His标签重组蛋白的诱导表达
如下以最常用的IPTG诱导表达系统给予说明,诱导表达条件的优化请参照所使用的诱导表达体系的详细说明。其它诱导表达系统请参考适当的使用说明进行。
- 挑取表达His标签重组蛋白的单克隆,接种到3mL或10~20mL含适当抗生素的LB培养液中,培养过夜。
- 按照1:20的比例取培养过夜的菌液,接种到预热至37℃并含适当抗生素的LB培养液中。例如取5mL培养过夜的菌液接种到100mL预热至37℃并含适当抗生素的LB培养液中。具体的培养体积视需要纯化的蛋白量而定,初步的鉴定培养3~10mL即可;常规的表达纯化,通常可考虑培养100~200mL;制备型的纯化,培养体积可以达到1L或更大。如果希望取得更好的表达效果,建议按照1:100的比例接种过夜培养的菌液,但后续培养至相应的OD值需要更长的时间。
- 37℃常规培养约30~60min或更长时间,至菌液的OD600达到0.5-0.7,并且OD600最好接近0.6。
- 加入IPTG至终浓度为1mM,继续培养4~5小时。
注:可以在加入IPTG前取出少量菌液同样培养4~5小时后作为未诱导的对照,也可以在加入IPTG前直接取出少量菌液作为未诱导的对照。对于特定蛋白的诱导表达,最佳的IPTG浓度、诱导温度、和诱导时间需要通过实验确定。 - 收集菌液至离心管中,4℃ 4000g离心20min或4℃ 15000g离心1min,弃上清,收集沉淀。随后即可进入细菌裂解步骤,也可以在-20℃或-80℃冻存备用。冷冻保存的菌体使用前需置于冰上解冻15min。
二、非变性条件下His标签蛋白的小量纯化:
本方法常用于小量样品的快速分析和鉴定,为后续大量制备打下基础。
- 接步骤一(5),离心收集1mL菌液的细菌沉淀并弃上清,加入100μL非变性裂解液,将细菌沉淀充分重悬于裂解液中,可进行轻微的vortex(尽量避免产生气泡)。
注:根据His标签重组蛋白表达的丰度,菌液和裂解液的体积比可以在25:1-5:1范围内适当调整。表达丰度非常高时,每毫升 菌液沉淀可以加入200μL裂解液;表达丰度非常低时,每毫升 菌液沉淀可以加入40μL裂解液。相关溶液的配制方法附后。本非变性裂解液可以确保裂解绝大多数可溶性蛋白和包涵体蛋白,裂解后可以直接用于SDS-PAGE。如有必要,可以在裂解细菌之前,在裂解液中添加适量的蛋白酶抑制剂混合物。 - 加入溶菌酶至1mg/mL并轻轻混匀,尽量避免产生气泡,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/mL的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。 - 轻轻vortex数下,以充分裂解细菌,尽量避免产生气泡。
- 4℃离心(15000g×10min),取10μL上清留样作后续检测用,收集余下上清至一新的洁净离心管中。
- 加入20μL混合均匀的50% GoldBalb His-tag Purification Resin,4℃在摇床上缓慢摇动30min,以充分结合带His标签的目的蛋白。
缓慢摇动30min已经可以确保蛋白充分结合,但可以根据时间安排的需要缓慢摇动更长时间甚至缓慢摇动过夜。经测试,直接使用50% GoldBalb His-tag Purification Resin也能获得良好的纯化效果。但如果希望获得更高的标签蛋白得率,可以参考步骤三(6),用一个柱体积的非变性裂解液平衡GoldBalb His-tag Purification Resin 2~3次。平衡后,视不同的待纯化蛋白而定,待纯化蛋白的得率有可能会提高约5~20%左右。 - 4℃离心(1000g×10s)沉淀凝胶,取20μL上清留样作后续检测用,其余上清弃去。
- 加入40μL非变性洗涤液重悬凝胶,4℃离心(1000g×10s),取20μL上清留样作后续检测用,其余上清弃去。
- 重复步骤7,再进行一次洗涤。
- 加入20μL非变性洗脱液,轻轻重悬凝胶。4℃离心(1000g×10s),收集上清及凝胶。上清即为纯化获得的带有His标签的目的蛋白。
- 重复步骤9两次。共洗脱收集约60μL纯化的蛋白样品。
三、非变性条件下His标签蛋白的大量纯化:
- 接步骤一(5),对于新鲜的或解冻的细菌沉淀,按照每克细菌沉淀湿重加入4mL(2~5mL均可)非变性裂解液的比例加入裂解液,充分重悬菌体。如有必要,可以在裂解细菌之前,在裂解液中添加适量的蛋白酶抑制剂混合物。
- 加入溶菌酶至终浓度为1mg/mL并混匀,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/mL的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。 - 冰上超声裂解细菌。超声功率200-300W,每次超声处理10s,每次间隔10s,共超声处理6次。
注:具体超声处理的方式须根据特定型号的超声仪器自行摸索和优化。 - (可选做)如果超声处理后裂解液非常粘稠,可以加入RNase A至10μg/mL及DNase I至5μg/mL,冰上放置10~15min。或者也可以使用适当的装好了较细针头的注射器,反复抽吸数次,以剪切粘稠的基因组DNA等。
- 4℃ 10000g离心20~30min,收集细菌裂解液上清并置于冰水浴或冰上。可以取20μL上清留作后续检测用。
注:上清必须保持澄清,即不含任何不溶物,才能进行下一步的纯化。上清中如果混有不溶性杂质会严重影响后续纯化获得蛋白的纯度。 - 取1mL混合均匀的50% GoldBalbHis-tag Purification Resin,4℃离心(1000g×10s)弃去储存液,向凝胶中加入0.5mL非变性裂解液混匀以平衡凝胶,4℃离心(1000g×10s)弃去液体,再重复重复平衡1~2次,弃去液体。将约4mL细菌裂解液上清加入其中,4℃在侧摆摇床或水平摇床上缓慢摇动60min。
注:GoldBalb His-tag Purification Resin也可以不平衡直接使用,但蛋白的得率有可能会有5~20%的下降。 - 将裂解液和GoldBalb His-tag Purification Resin的混合物装入试剂盒提供的亲和层析柱空柱管中。
注:也可先取1mL混合均匀的50% GoldBalb His-tag Purification Resin装柱,然后用0.5mL非变性裂解液平衡2~3次后加入约4mL细菌裂解液上清,后续可以把穿流液收集后重复上柱3~5次以充分结合目的蛋白。先混合后装柱的方式操作起来相对麻烦一些,但更有利于带有His标签重组蛋白与镍柱的充分结合,特别是当His标签被蛋白本身部分遮挡或His标签重组蛋白浓度很低时与镍柱的结合效率会高一些。 - 将纯化柱底部的盖子打开,在重力作用下使柱内液体流出,收集约20μL穿流液作后续分析用。
- 洗柱5次,每次加入0.5~1mL非变性洗涤液,每次均收集约20μL穿柱的洗涤液用于后续的分析检测用。洗柱及下一步洗脱过程中可以用Bradford法(CAT#YT034)简单快速地检测每次洗涤液和洗脱液中的蛋白含量,从而考虑增加或减少洗涤和洗脱的次数。
注:如果出现后续获得蛋白纯度不够高的情况,可以再增加洗柱次数2~3次。 - 洗脱目的蛋白6~10次,每次用0.5mL非变性洗脱液洗脱。将每次的洗脱液分别收集到不同的离心管中。收集获得的洗脱液即为纯化的His标签蛋白样品。蛋白纯化效果可以参考图1。
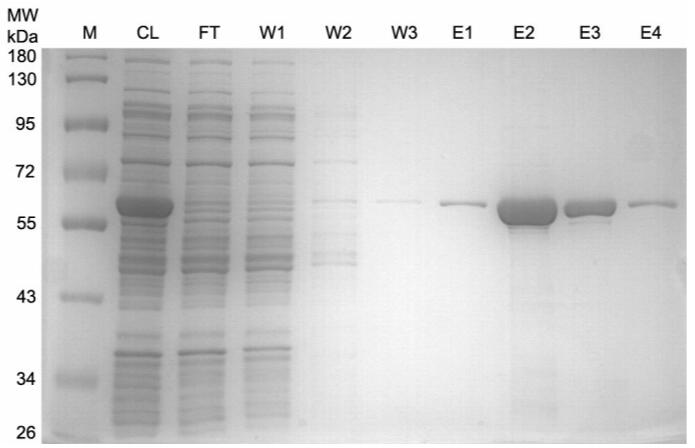
图1.His标签重组蛋白纯化效果图。
M:marker;
CL:细菌裂解液(cell lysate);
FT:上样穿流液(flow through);
W1-W3:洗涤液1-3(wash 1-3);
E1-E4:洗脱液1-4(elution 1-4)。
注:实际的电泳结果会因样品、上样量等的不同而有所不同。
四、简化的操作流程:
- 细菌中的目的蛋白诱导表达后,离心沉淀细菌。
- 每克细菌沉淀湿重加入4mL非变性裂解液,可添加适量蛋白酶抑制剂,充分重悬细菌。
- 加入溶菌酶至终浓度为1mg/mL并混匀,冰水浴或冰上放置30min。
注:溶菌酶可以用裂解液配制成100mg/mL的母液,临使用前加入。溶菌酶配制成母液后,可以适当分装后-20℃保存。 - 冰上超声裂解细菌,离心取上清。
- GoldBalb His-tag Purification Resin装柱,1mL非变性裂解液平衡纯化柱2次。
- 步骤四(4)中的上清上柱。
注:上清上柱是可以收集穿流液并重复上柱3~5次,以充分结合His标签蛋白。 - 用0.5mL非变性洗涤液洗柱5次。
注:如果出现咪唑浓度偏低的情况,可以自行添加适量咪唑,如果出现咪唑浓度偏高的情况,可以使用试剂盒提供的非变性裂解液作为洗涤液使用。 - 用0.5mL非变性洗脱液洗脱6~10次。
注:通常该洗脱条件会比较理想。如果出现洗脱效果欠佳的情况,可以自行提高咪唑浓度至100~250mM。

如果纯化不成功,可以对纯化过程中收集的每个组分进行SDS-PAGE电泳检测,分析其原因。
- 蛋白无法与GoldBalb His-tag Purification Resin结合
- 测序检查基因序列的读码框是否正确。
- 尝试将标签加在蛋白的另一端。
- 增加GoldBalb His-tag Purification Resin与蛋白结合时间(如4℃过夜)。
- 如果使用预装柱,可收集裂解液上柱后的穿流液并多次重复上柱。
- 检查所有缓冲液和溶液的pH值是否正确。
- 确认体系中所用各种试剂的浓度在镍柱的耐受范围以内。
- 降低结合缓冲液中的咪唑浓度。
- 目的蛋白被洗涤液洗脱
- 降低洗涤液中的咪唑浓度或者稍微提高其pH值。
- 检查洗涤液的pH和成分。
- 确认洗涤液中各种试剂的浓度在耐受范围内。
- 蛋白在纯化过程中形成沉淀
- 将纯化温度控制在室温。
- 加入去垢剂,如0.1%Triton X-100或者Tween-20。
- 蛋白无法洗脱
- 用梯度pH及咪唑洗脱,确定最优洗脱条件。
- 目的蛋白与其它蛋白共同洗脱
- 提高结合缓冲液和洗涤液中的咪唑浓度。
- 降低GoldBalb His-tag Purification Resin的使用量。
- 加入DTT或β-巯基乙醇打开二硫键。
- 增加盐或者去垢剂浓度,或者向洗涤液中加入乙醇或甘油以降低非特异相互作用。
- 检查基因内部是否含有起始密码子(C端标记蛋白)或者提前终止位点(N端)

关于GoldBalb His-tag Purification Resin:
- GoldBalb His-tag Purification Resin对His标签重组蛋白的亲和力强、选择性高、结合容量大,可以获得高纯度的His标签重组蛋白,可用于简单、快速、高效地纯化细菌、哺乳动物细胞、昆虫及杆状病毒等多种表达系统中表达的His标签重组蛋白。纯化的蛋白可以用于结构和功能研究、抗体制备、蛋白与蛋白相互作用、蛋白与核酸相互作用等方面的研究。
- GoldBalb His-tag Purification Resin采用了一种高度交联的6%琼脂糖凝胶(Sepharose CL-6B)为基质,并使用了进一步优化的接臂和镍离子螯合技术,和目前市售的大多数Ni-NTA agarose或类似产品相比,非特异性蛋白结合显著降低,耐受压力强,镍离子螯合非常稳定。和同类产品相比,本制品由于镍离子基本不会流失,重复使用本纯化介质时不需要重新装载镍离子。
- Ni-NTA agarose以及绝大多数类似的镍柱产品不能耐受蛋白样品中常见浓度的还原剂如二硫苏糖醇(DTT)、β-巯基乙醇等以及常见浓度的螯合剂如EDTA等,但GoldBalb His-tag Purification Resin可以很好地耐受DTT等还原剂以及EDTA等螯合剂。本制品可耐受20mM DTT等还原剂,以及20mMEDTA等螯合剂。这为需要添加还原剂或螯合剂的蛋白样品的纯化提供了可能性。本制品不兼容8M尿素和6M盐酸胍。对于包涵体蛋白的纯化,在采用8M尿素或6M盐酸胍溶解蛋白的情况下,需要通过透析去除尿素和盐酸胍后才能使用本制品进行His标签蛋白的纯化。
- GoldBalb His-tag Purification Resin已经螯合了镍离子,呈蓝色,凝胶的颗粒直径为45~165μm。可耐受的最大压力为0.025MPa,约合5.8psi。采用固定流速进行蛋白纯化时的推荐流速为0.5mL/min。
- GoldBalb His-tag Purification Resin可以高容量、高特异性地结合His标签蛋白。最大蛋白结合量为20~30mg蛋白/mL凝胶。实际使用时的最大结合量取决于待纯化的His标签重组蛋白的分子量大小,分子量越大则最大结合容量越大,分子量越小则最大结合容量越小。对于分子量为50kD的蛋白,每毫升 凝胶的实际最大纯化量约为6~10mg,对于分子量为100kD的蛋白,每毫升 凝胶的实际最大纯化量约为12~20mg。但对于分子量相同的蛋白,也会因为蛋白本身特性的不同,结合的最大容量也会有所不同。
相关搜索:His标签蛋白纯化试剂盒(还原剂和螯合剂耐受),镍柱试剂盒,His标签融合蛋白纯化试剂盒,His标签蛋白纯化试剂盒,His标签纯化试剂盒,GoldBalb His-tag Protein Purification Kit



